题目
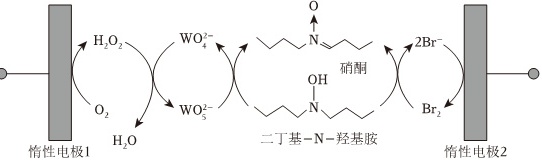
硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。o-|||-H2O2 (N{O)_(4)}^2- N --|||-OH o-|||-硝酮-|||-O2 WO^2- N Br 2 k-|||-惰性电极1 H2O 二丁基 -N- 羟基胺-|||-惰性电极2下列说法错误的是( )A. 惰性电极2为阳极B. 反应前后(WO)_(4)^2-/(WO)_(5)^2-数量不变C. 消耗1mol氧气,可得到1mol硝酮D. 外电路通过1mol电子,可得到1mol水
硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成。电解槽中水溶液的主要成分及反应过程如图所示。
下列说法错误的是( )

下列说法错误的是( )
- A. 惰性电极2为阳极
- B. 反应前后${WO}_{4}^{2-}$/${WO}_{5}^{2-}$数量不变
- C. 消耗1mol氧气,可得到1mol硝酮
- D. 外电路通过1mol电子,可得到1mol水
题目解答
答案
C. 消耗1mol氧气,可得到1mol硝酮
解析
步骤 1:确定电极类型
根据图示,惰性电极2上发生Br^{-}被氧化为Br_2的反应,因此惰性电极2为阳极。阳极发生氧化反应,阴极发生还原反应。
步骤 2:分析${WO}_{4}^{2-}$/${WO}_{5}^{2-}$的循环
${WO}_{4}^{2-}$/${WO}_{5}^{2-}$在反应中起到电子传递的作用,它们在反应前后数量不变,可以循环使用。
步骤 3:计算消耗1mol氧气生成的硝酮量
根据图示,氧气最终生成水,二丁基-N-羟基胺被氧化为硝酮。1mol二丁基-N-羟基胺失去2molH原子生成1mol硝酮,因此消耗1mol氧气,可得到2mol硝酮。
步骤 4:计算外电路通过1mol电子生成的水量
外电路通过1mol电子,生成0.5molH_2O_2,H_2O_2最终生成水,根据氧原子守恒,可得到1mol水。
根据图示,惰性电极2上发生Br^{-}被氧化为Br_2的反应,因此惰性电极2为阳极。阳极发生氧化反应,阴极发生还原反应。
步骤 2:分析${WO}_{4}^{2-}$/${WO}_{5}^{2-}$的循环
${WO}_{4}^{2-}$/${WO}_{5}^{2-}$在反应中起到电子传递的作用,它们在反应前后数量不变,可以循环使用。
步骤 3:计算消耗1mol氧气生成的硝酮量
根据图示,氧气最终生成水,二丁基-N-羟基胺被氧化为硝酮。1mol二丁基-N-羟基胺失去2molH原子生成1mol硝酮,因此消耗1mol氧气,可得到2mol硝酮。
步骤 4:计算外电路通过1mol电子生成的水量
外电路通过1mol电子,生成0.5molH_2O_2,H_2O_2最终生成水,根据氧原子守恒,可得到1mol水。