题目
1.某均相化学反应 +Barrow C 在等压绝热非体积功为零的条件下进行,系统的温度由-|||-T1升高到T2,则此过程的 Delta H __ 0;如果此反应是在等温等压不做非体积功的条件下-|||-进行,则 Delta H __ 0。

题目解答
答案
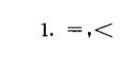
解析
步骤 1:理解等压绝热条件下的 $\Delta H$
在等压绝热条件下,系统与外界没有热量交换,因此 $\Delta H = Q_p$,其中 $Q_p$ 是在等压条件下系统与环境交换的热量。由于系统温度升高,说明反应放热,因此 $\Delta H = Q_p < 0$。
步骤 2:理解等温等压条件下的 $\Delta H$
在等温等压条件下,系统与环境交换的热量等于焓变 $\Delta H$。由于反应放热,系统温度升高,说明反应放热,因此 $\Delta H < 0$。
在等压绝热条件下,系统与外界没有热量交换,因此 $\Delta H = Q_p$,其中 $Q_p$ 是在等压条件下系统与环境交换的热量。由于系统温度升高,说明反应放热,因此 $\Delta H = Q_p < 0$。
步骤 2:理解等温等压条件下的 $\Delta H$
在等温等压条件下,系统与环境交换的热量等于焓变 $\Delta H$。由于反应放热,系统温度升高,说明反应放热,因此 $\Delta H < 0$。